科技日報記者 張夢然
最新一期《自然·生物技術》發表一項由美國Arc研究所、格萊斯頓研究所和加州大學舊金山分校科學家合作完成的重要成果:他們將基因工程與表觀遺傳工程結合,研發出一種新型表觀遺傳編輯平臺,能同時修改人類T細胞中多個基因,實現了對T細胞的高效、安全多基因調控,為突破下一代細胞療法瓶頸提供了解決方案。
當前,以CAR-T為代表的T細胞療法已在血癌治療中展現出顯著療效。這類療法通過改造患者自身的免疫細胞,使其精準識別并摧毀癌細胞。然而,面對實體瘤時,這類療法往往難以奏效。原因在于實體瘤微環境惡劣,會持續刺激T細胞,導致其功能衰竭,最終失去戰斗力。
為應對這一挑戰,研究人員試圖利用CRISPR等基因編輯技術,構建功能更強的“裝甲”T細胞,但傳統方法在同時編輯多個基因時,常因DNA雙鏈斷裂引發細胞毒性,導致大量T細胞死亡,嚴重限制了可擴展性和臨床應用。
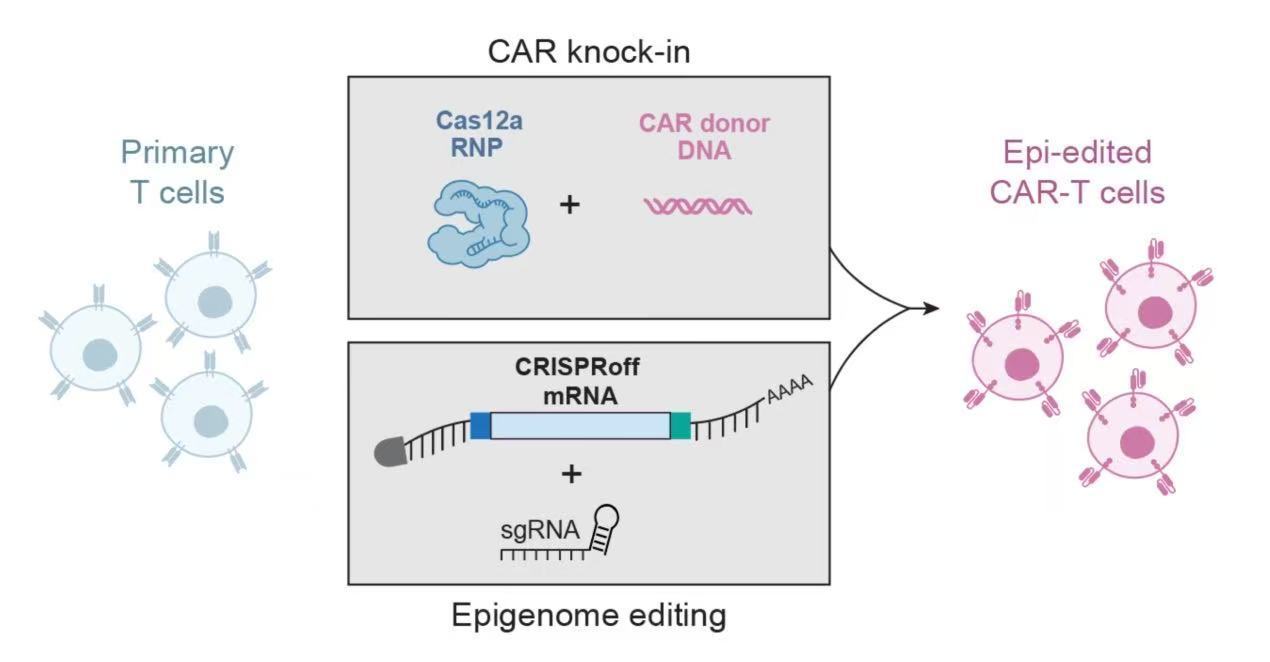
此次開發的新平臺基于CRISPRoff和CRISPRon技術,巧妙避開了這一難題。與傳統基因編輯不同,這兩種工具不切割DNA,而是通過表觀遺傳修飾,在基因啟動子區域添加或去除甲基化標記,從而可逆地關閉或激活目標基因。這種方式既避免了基因組損傷,又能實現穩定的基因表達調控。
實驗表明,該平臺可同時修飾多達5個基因,且T細胞存活率顯著高于傳統方法。研究人員介紹說:“只需短暫引入表觀遺傳編輯器,T細胞就能‘記住’這些指令。即使經過多次分裂和反復免疫刺激,基因沉默效果依然穩定維持。”他們利用這一平臺構建了增強型CAR-T細胞,一方面通過基因工程插入靶向癌細胞的受體,另一方面使用CRISPRoff沉默RASA2基因(一種抑制T細胞活性的“分子制動器”)。
在實驗室中,這些經過雙重改造的T細胞展現出更強的持久性和抗腫瘤能力,在多次攻擊癌細胞后仍未衰竭;而未沉默RASA2基因的標準CAR-T細胞則迅速失去功能。在小鼠白血病模型中,增強型CAR-T細胞顯著提升了腫瘤控制效果和動物生存率。這種方法不僅提升了T細胞的功能,還具備系統性重編程的潛力,有望以可擴展的方式生產更高效的治療產品。
目前,研究人員正積極規劃后續的人體試驗,相信這項技術將推動下一代CAR-T療法的發展,特別是在攻克實體瘤方面,將為更多患者帶來希望。
總編輯圈點
雖然CAR-T療法在血癌治療中效果顯著,但它對付實體瘤依然力不從心。T細胞進入實體瘤微環境后容易力竭,需裝備更加有力的武器才能對實體瘤展開持續攻擊。此次,科研人員改良了基因剪刀技術,不進行基因剪切,而是給目標基因進行標記,給它們裝上開關,讓其能夠根據需要打開和關閉,從而制造出更加強大的“裝甲”T細胞。實驗證明,當關上抑制T細胞活性的基因后,增強版T細胞可以“大殺四方”。這項技術為實體瘤的細胞療法打開了新的大門。