科技日報記者 劉霞
韓國科學家開發出一種新型雙模CRISPRa/i基因編輯系統,能同時“開啟”和“關閉”不同基因,突破了現有CRISPR技術多局限于“關閉”基因的瓶頸。這一進展為研究合成生物學及其在工業領域的應用提供了全新工具,相關研究成果發表于新一期《核酸研究》雜志。
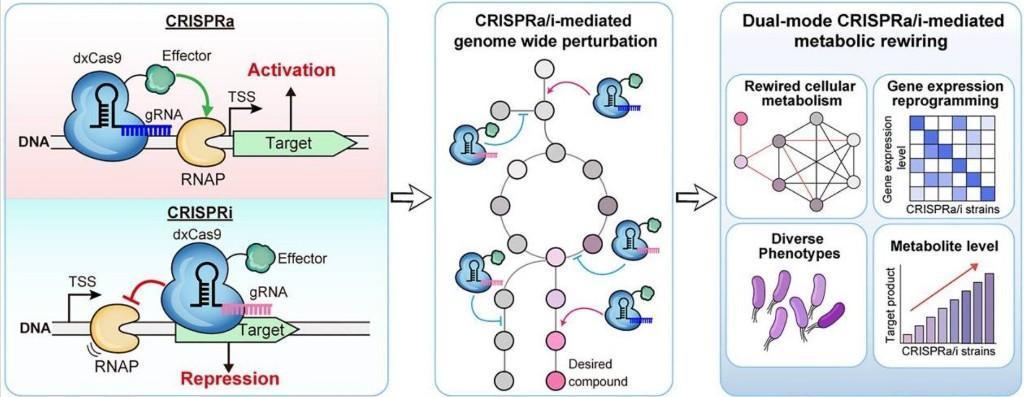
該研究由韓國科學技術院生物工程研究生院與韓國化學技術研究所合作完成。團隊利用新系統,在大腸桿菌中實現了基因的同步激活與抑制。基因被激活時,蛋白質或其他物質的合成得到促進;反之則合成受限。大腸桿菌具有結構簡單、繁殖迅速的特點,是合成生物學中常用的“微生物工廠”。
合成生物學的核心在于設計遺傳通路,使生物體執行特定功能。如同電路開關,代謝途徑的優化需要精準控制基因的“開”與“關”。團隊開發的雙模基因剪刀,正是實現這一目標的關鍵工具。
傳統CRISPR技術在基因抑制方面表現優異,但激活基因的能力有限。此外,其作用依賴于特定的DNA識別序列——原間隔區鄰近基序(PAM),而PAM識別范圍較窄,限制了可調控基因的數量。盡管CRISPR激活技術(即通過CRISPR系統強制激活而非編輯基因)已在動植物等真核細胞中取得進展,但由于細菌轉錄機制不同,在細菌中的應用效果一直不理想。
為突破這一局限,研究團隊拓展了靶基因范圍,并利用大腸桿菌自身蛋白顯著提升了基因激活效率。最終,原本“偏重抑制”的基因剪刀升級為可同步調控“開/關”的雙模系統。
在后續實驗中,新系統展現出卓越性能。基因激活實驗中,目標蛋白質表達量提升至4.9倍;抑制實驗中,蛋白質產量下降83%。更令人矚目的是,系統成功實現對兩個基因的同步調控:一個基因活性提升8.6倍,另一個則被抑制90%。
團隊表示,新型雙模CRISPR系統為代謝途徑優化、基因網絡研究及細菌功能基因組學的發展提供了強大工具,有望促進高價值化合物、生物燃料及藥品的高效生產。
總編輯圈點
這一研究遠不止于技術層面的升級,它也是合成生物學精密編程的關鍵一步,意味著我們對微生物工廠的控制力從“踩剎車”進化到了“油門與剎車協同操控”。這將極大加速高價值化合物、生物燃料和新型藥物的生物制造進程,為設計更復雜、更智能的基因回路提供了核心工具,真正推動合成生物學走向“按需設計生命功能”的新階段。